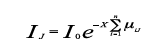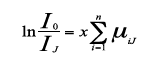RAYOS X
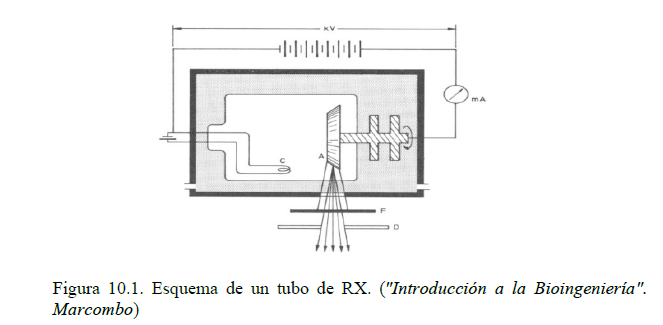
Los rayos X son ondas electromagnéticas ionizantes de origen no nuclear. Se obtienen cuando un haz de electrones acelerados se hace incidir sobre una estructura atómica. En aplicaciones médicas, para generar rayos X se utiliza un tubo electrónico. Los electrones generados en el cátodo (C) son acelerados por la diferencia de potencial entre dicho cátodo y el ánodo (A). La interacción de los electrones con los átomos el ánodo, generalmente fabricado en tungsteno, genera los rayos X en todas las direcciones, pero debido a la inclinación del ánodo se logra que exista una dirección determinada de predominio de emisión. El tubo, en el que se ha hecho el vacío, está refrigerado por aceite (el ánodo también es giratorio para mejorar la disipación calórica), y rodeado por una pantalla de protección frente a la radiación no deseada. La radiación útil sale a través de una ventana, que dispone de un filtro (F) para absorber la radiación menos energética y un diafragma (D) que regula las dimensiones del haz útil.
Las características del haz de RX generado (haz incidente) se regula mediante la diferencia de potencial aplicada entre ánodo y cátodo (expresada en kV; a mayor valor, mayor capacidad de penetración en el tejido), el filtro y el diafragma utilizado.
Cuando el haz incidente penetra dentro del organismo, una cierta cantidad de
fotones (aproximadamente un 5% del total) no interacciona y lo atraviesa sin
modificación en su dirección, formando el haz resultante. El resto interacciona
produciéndose variaciones en su trayectoria, y dando lugar a lo que se conoce como
radiación secundaria, que es eliminada mediante una parrilla antidifusora colocada antes
del detector.
El número de fotones N del haz resultante puede obtenerse a partir del número No de fotones del haz incidente sobre un espesor x de materia, mediante la ley general de
atenuación:
N = No · e-μx
donde μ es el coeficiente lineal de atenuación, que depende de la energía del haz y del medio. Puesto que μ presenta valores diferentes para distintos de tejidos (existe mayor atenuación en el hueso y menor en tejidos blandos), determina el contraste entre diferentes zonas de la imagen resultante. Para dos tejidos adyacentes con coeficientes de atenuación μ1 y μ2, suponiendo que ambos tienen el mismo espesor x, podemos definir el contraste C entre ambos:
C = (μ1-μ2) · x / 2
Por tanto, la calidad de la imagen depende fundamentalmente de la diferencia entre coeficientes de atenuación, por lo que aumentar la energía del haz de radiación por encima del valor mínimo necesario sólo produce un exceso de irradiación al paciente. Las tensiones habituales de trabajo oscilan entre 60 y 120 kilovoltios
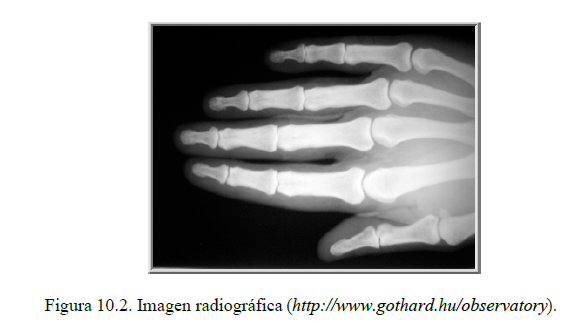
El haz resultante puede ser finalmente visualizado mediante pantallas radioscópicas o películas radiográficas, que generan una imagen en negativo en la cual los tejidos que producen mayor atenuación (hueso) se visualizan en blanco y los de menor atenuación (pulmones) en negro, con diferentes tonos de grises para los casos intermedios.
Una modalidad diagnóstica de los rayos X, fundamentalmente relacionada con patologías del sistema circulatorio, es la angiografía. En este caso, se opacifica el vaso o vasos sanguíneos de interés mediante la inyección de agentes de contraste radioopacos, ya que el coeficiente de atenuación de la sangre es muy similar al del resto de tejidos blandos. Cuando la imagen radiográfica es digitalizada, se utiliza una variante (DSA: Digital Substraction Angiography) en la que se obtiene una imagen diferencia entre la imagen del vaso previa y posterior a la inyección del agente de contraste que, idealmente, sólo contiene el objeto de interés.
Resonancia magnética nuclear
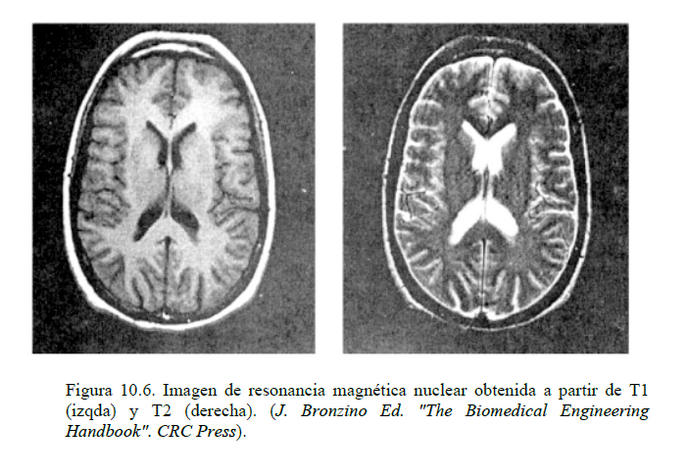
La resonancia magnética nuclear (RMN) se basa en la absorción selectiva de energía de radiofrecuencia por parte de ciertos núcleos sometidos a un campo magnético externo e irradiados por una señal de radiofrecuencia (fenómeno de resonancia).
Posteriormente, cuando esta energía se disipa (fase de relajación), se genera una señal que proporciona información sobre la densidad y la estructura biomolecular en que se encuentran estos núcleos.
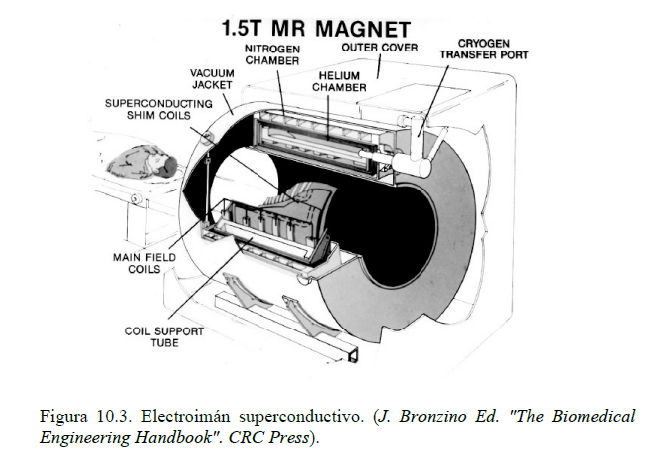
Para obtener la señal de resonancia es necesario generar un campo magnético lo más uniforme y estable posible en el espacio útil donde va a ser explorado el paciente y durante el tiempo que va a durar la exploración. Este campo está producido por imanes permanentes o por electroimanes.
Los primeros tienen como ventajas un bajo
mantenimiento y alta estabilidad, pero presentan valores del campo pequeños (hasta 0,3T). Los segundos se dividen en dos tipos:
- Resistivos o disipativos: utilizan una corriente de alta intensidad circulando por un conductor de cobre. Presentan limitaciones debido a la capacidad de disipación calórica, por lo que no pueden sobrepasar los 0,4 T, además de un elevado gasto de mantenimiento (eléctrico y refrigeración), y problemas con la estabilidad del campo magnético.
- Superconductivos: utilizan superconductores para disminuir el mantenimiento (se elimina el gasto eléctrico), pero el conductor debe estar a temperaturas muy bajas. Se consiguen campos magnéticos con buena estabilidad y valores más elevados (entre 0,15 y 2 T).
Para obtener un campo magnético lo más uniforme posible en el volumen de exploración (el caso ideal correspondería al del interior de una esfera con el conductor uniformemente enrollado sobre su superficie), se diseñan los electroimanes con una estructura que se asemeje lo más posible a dicha esfera. Los tipos más usuales son los de anillos y los de solenoide.
Obtención de la señal de relajación
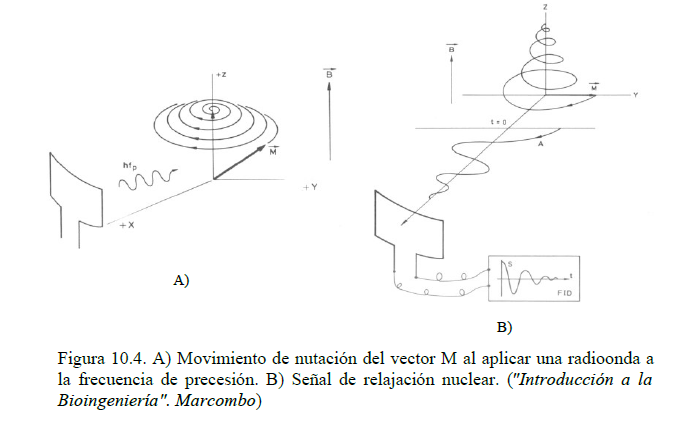
Cuando colocamos un elemento de volumen en un campo magnético externo B (supongámoslo orientado según el eje Z), el vector magnetización (M) resultante de los átomos que conforman dicho elemento de volumen tiende a alinearse con la dirección del vector campo magnético.
No obstante, al aplicar una radiación electromagnéticas de frecuencia fp, el vector magnetización tiende a alinearse con el nuevo campo magnético efectivo, compuesto por la componente magnética de la radiación y el campo magnético constante inicial (B), describiendo una trayectoria espiral (movimiento de nutación) a la frecuencia de precesión fp (figura 10.4 A).
Cuando cesa la emisión de radiofrecuencia, el vector M se ha desplazado un cierto ángulo respecto del eje Z. Este ángulo final sirve para cuantificar el efecto producido y depende de la intensidad de la radiación, de su duración y de las propiedades magnéticas de los núcleos irradiados. Debido a que la duración de la emisión es pequeña, del orden de los μs, normalmente se habla de pulso de radiofrecuencia y, si el resultado es una desviación de α° del vector magnetización, diremos que se ha enviado un pulso de α°.
Tras el cese de la radiación, el vector M volverá a alinearse de nuevo con el campo magnético externo B en la dirección Z describiendo una espiral a la frecuencia de precesión. Este proceso se conoce con el nombre de relajación nuclear. Si localizamos un detector en el plano X-Y, podremos captar la proyección de esta espiral sobre dicho plano con el tiempo, obteniéndose una sinusoide amortiguada (figura 10.4 B). La envolvente de esta proyección es la componente transversal de la señal de relajación, y puede expresarse
como:
MT(t)= MT(0) exp (-t/T2)
donde:
- MT(t) es el valor en el instante t de la proyección sobre el plano X, Y de la relajación de M.
- MT(0) es el valor inicial en dicho plano después de enviar el pulso.
- T2 es el tiempo de relajación transversal (en ms).
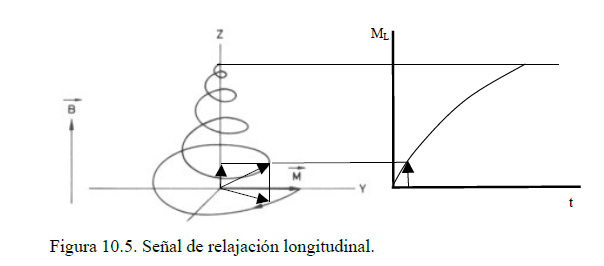
Análogamente, podemos estudiar la componente longitudinal de la señal de relajación, correspondiente a la proyección de M sobre el eje Z (figura 10.5), y que puede expresarse como:
ML(t)= M0 [1-K1 exp (-t/T1)]
donde:
ML(t): valor de la proyección longitudinal en el momento t
M0 : valor de la magnetización inicial antes de enviar el pulso.
K: constante que depende, entre otros factores, del pulso inicial.
T1: tiempo de relajación longitudinal (en ms).
El estudio de la señal de relajación permite obtener información de la densidad de núcleos del elemento de volumen que han entrado en resonancia y del entorno bioquímico en que se encuentran, a través de: 1) T1, que indica la facilidad de disipación energética según el medio (por ejemplo, la disipación es más rápida en lípidos que en líquidos, por lo que T1 será más corto en el primer caso); 2) T2, que indica la sincronización con que se relajan todos los átomos del elemento de volumen (esto implica que no hay una única fp para todos los átomos, sino que existe una banda de frecuencias, con ancho de banda y valor de T2 mayores cuanto menor es la sincronización, como ocurre en los líquidos).
Ultrasonidos
Dentro del área de diagnostico por imagen, los ultrasonidos se utilizan frecuentemente en medicina por su capacidad de visualizar tejidos blandos y por su inocuidad frente a otros métodos basados en radiaciones. La ecografía se basa en la transmisión de un pulso acústico al interior del cuerpo explorado y la detección del eco reflejado en los tejidos. El tiempo de retraso entre la señal y el eco correspondiente permite medir la profundidad del tejido en que se produjo. Las frecuencias utilizadas están en el rango de 1 a 15 MHz, y las intensidades entre 0,002 y 0,5 W/cm2.
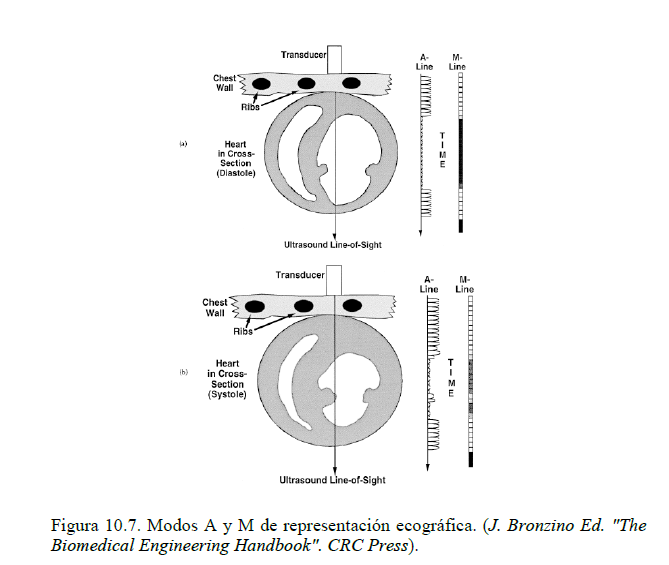
Los distintos formatos de presentación en pantalla de las imágenes ultrasónicas se denominan modos. El más simple es el modo A, en el cual se representa la amplitud de los ecos en ordenadas y el tiempo en abscisas, pero su interpretación es más difícil. El modo M representa en niveles de color la intensidad del eco, la profundidad en ordenadas y la evolución temporal en abscisas. La siguiente figura muestra un ejemplo de estos modos.
El resto de modos también representa la intensidad del eco en niveles de gris o color. La imagen obtenida es una sección del cuerpo explorado correspondiente al plano en que se realiza la deflexión del haz ultrasónico. La diferencia entre ellos se basa fundamentalmente en la forma en que el transductor hace el barrido del área seleccionada.
Este barrido puede ser manual, estando incorporado el transductor a un brazo articulado de unión con el equipo que codifica la posición y que mueve el usuario, o automático, siendo entonces el sistema el que realiza el barrido. En el primer caso, como ocurre en el modo B estático, no se obtiene una presentación en tiempo real, por lo que no pueden estudiarse estructuras dinámicas como el músculo cardiaco, pero sí estructuras cuasiestáticas, como las abdominales. En el segundo, que corresponde a los denominados modos B en tiempo real, se obtienen distintos formatos de imagen según el movimiento del transductor. Por ejemplo, el formato sectorial presenta una imagen en forma de abanico, y se utiliza para acceder a tejidos a través de ventanas de visión reducida, como ocurre en la ecocardiografía en que el barrido ha de hacerse a través de la separación intercostal.
En los modos doppler, se superpone a la imagen ecográfica convencional la información de flujo codificada en colores en vez de escala de grises. El color rojo se usa para flujos que se aproximan al transductor, mientras el azul indica flujos que se alejan de él. La intensidad del color indica mayor o menor velocidad.
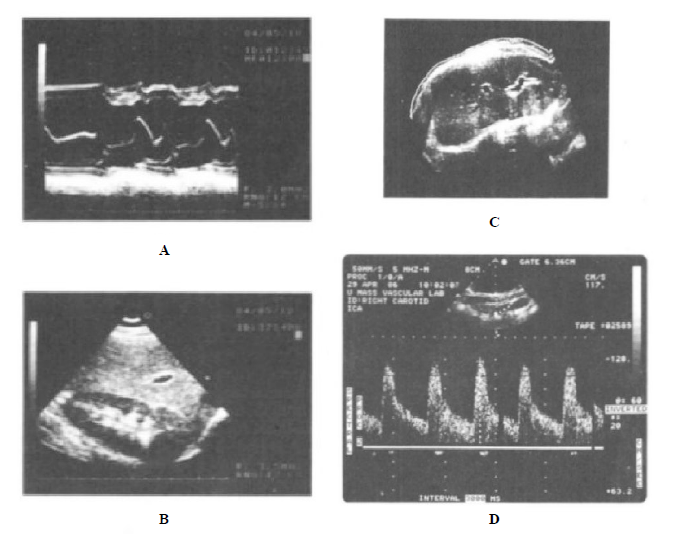
Figura 10.8. Imágenes ecografícas; a) modo M; b) modo B sectorial; c) modo estático; d) modo doppler.
Obtención de imágenes en medicina nuclear
En medicina nuclear se utilizan sustancias radiactivas para la obtención de imágenes, mediante la combinación con otras para obtener trazadores radiactivos que se distribuyen por el organismo tras ser inyectados al paciente, emitiendo una radiación que puede ser detectada mediante dispositivos externos. La información que se obtiene permite establecer un mapa de distribución del trazador así como la evolución temporal del mismo.
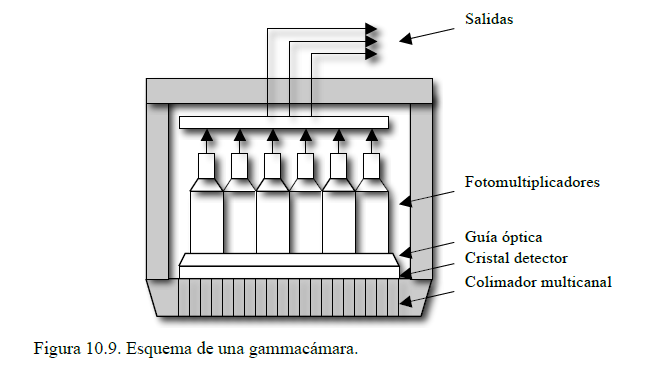
Podemos establecer dos clases de métodos en función del elemento radiactivo usado. La primera se basa en la utilización de elementos radiactivos emisores de radiación gamma. La segunda utiliza radioelementos emisores de positrones generados a partir de pequeños aceleradores de partículas. La cámara de Anger o gammacámara es el dispositivo de detección de la radiación emitida por el trazador más utilizado en el primer tipo de métodos. Está constituida por una matriz de fotomultiplicadores, cada uno de los cuales amplifica la señal generada por el cristal detector en su área correspondiente (figura 10.9). Esto proporciona información tanto de la intensidad de la radiación como de su localización espacial. La utilización de un colimador a la entrada limita el campo de visión del detector.
La conexión de la gammacámara a un computador permite obtener diferentes tipos de imágenes, incluso de cuerpo entero dotando de movimiento a la gammacámara controlado por el computador.
Otra técnica es la tomografía de emisión de fotones aislados (SPECT: Single- Photon Emission Computed Tomography), que utiliza isótopos que producen un único fotón gamma. La obtención de la imagen suele realizarse dotando a una gammacámara de un movimiento de rotación alrededor del cuerpo del paciente y generando a partir de las imágenes obtenidas una reconstrucción 3D. Permite obtener mayor resolución que en la técnica anterior y es válida para visualizar estructuras cuasiestáticas.
La tomografía por emisión de positrones (PET: Positron Emission Tomography) se basa en la utilización de elementos emisores de positrones producidos en pequeños ciclotrones. Cuando interaccionan con un electrón, ambas partículas se aniquilan, liberando su energía en forma de dos fotones gamma, con una energía de 511 keV, que son emitidos en direcciones opuestas, por lo que detectando estas direcciones puede determinarse la región de origen. La detección se realiza mediante gammacámaras situadas en posiciones opuestas del paciente, que giran para detectar las direcciones de emisión. Los sistemas de última generación utilizan múltiples gammacámaras dispuestas en anillo, evitando el movimiento de rotación y permitiendo múltiples detecciones simultáneas, con lo que se reduce el tiempo de exposición del paciente a la radiación y de adquisición de la imagen.
La cantidad medida en imagen PET es la concentración del trazador en el tejido. En la práctica suelen realizarse estudios en los que el trazador es un aminoácido o bien glucosa marcada con un emisor de positrones, obteniendo imágenes que reflejan aquellas zonas en las que se produce un mayor consumo de estas substancias, habiéndose utilizado para obtener mapas de actividad cerebral.
Tomografía axial computerizada
Una de las principales limitaciones de las imágenes radiográficas es su obtención según una única dirección de propagación, lo que implica la superposición de tejidos con diferentes coeficientes de atenuación, impidiendo los de mayor valor la detección del resto. La solución a este problema sería la obtención de imágenes para cada posible proyección, pero esto resulta inviable porque se superaría la dosis máxima de radiación que puede recibir de forma segura el paciente.
Una alternativa la constituye la tomografía computerizada (TC), en la cual se realiza una reconstrucción digital de la imagen en un corte transversal al paciente a partir de las proyecciones en diversas direcciones, mediante barridos perpendiculares al eje Z (el correspondiente a la vertical del paciente). El ancho (Δz) del corte viene determinado por las dimensiones del detector, por lo que el resultado es un mapa tomográfico de los coeficientes de atenuación asociados a cada punto de la imagen (pixel), pero que en realidad representan los asociados a los elementos de volumen (voxel). Las dimensiones de este voxel vienen fijadas por la matriz de adquisición, que fija la resolución espacial determinando los pixels en que se divide la imagen.
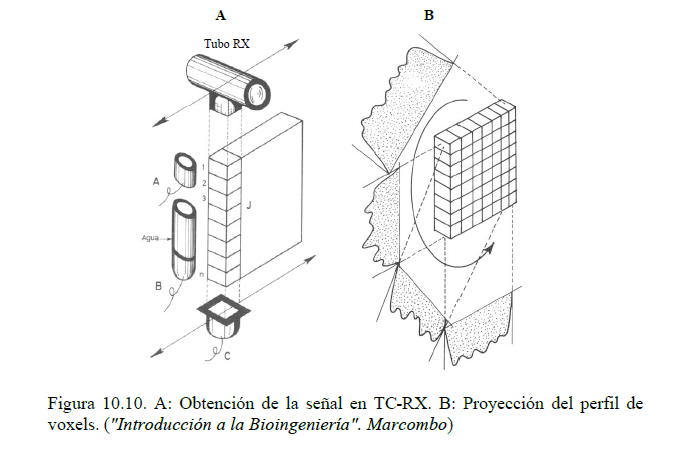
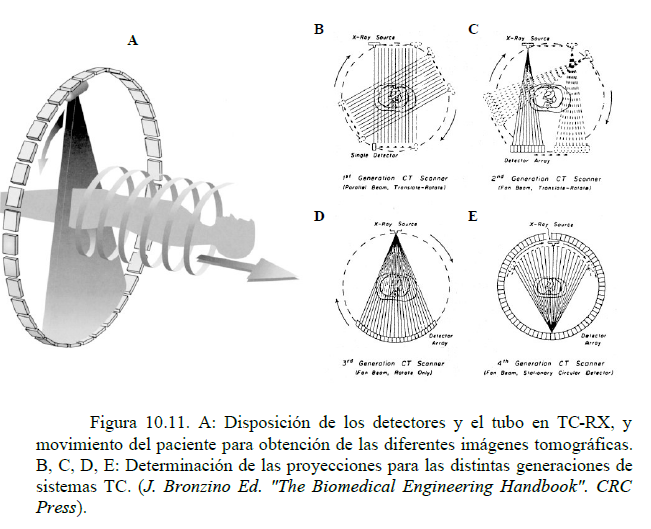
Para ilustrar el método de obtención de la imagen en TC de rayos X (TC-RX), la figura 10.10A muestra el funcionamiento de los sistemas de primera generación. En lados opuestos del paciente se colocan un tubo de RX y un detector (C), con un diafragma de apertura regulable que fija el grosor del voxel. La intensidad incidente del tubo se mide con un detector adicional (A), permitiendo corregir las fluctuaciones de la emisión.
Además, para poder normalizar posteriormente los resultados respecto del coeficiente de atenuación del agua, se utiliza un tercer detector (B) unido a un recipiente con agua de volumen conocido.
La señal recogida por el detector C es la correspondiente a la resultante atenuada por la suma de los coeficientes de atenuación de los elementos de volumen de la columna
siendo: coeficiente de atenuación del elemento de la fila i y de la columna j.
x : dimensión del voxel en la dirección de irradiación.
n : número de filas de la matriz de adquisición.
y : en forma logaritmica:
Para cada columna de la matriz de adquisición, el tubo de rayos X y el detector se desplazan síncronamente sobre el plano de elementos de volumen, obteniendo tantos valores como columnas. El conjunto de todos ellos constituye una proyección del plano de volúmenes en la dirección del movimiento del detector (figura 10.10B). El proceso se repite para distintos ángulos de proyección, obteniéndose las ecuaciones necesarias para obtener todos los coeficientes de atenuación de la matriz de adquisición.
La figura 10.11 muestra la disposición de los detectores y el tubo en TC-RX, y movimiento del paciente para obtención de las diferentes imágenes tomográficas, y las geometrías de proyección utilizadas en los sistemas TC de las cuatro primeras generaciones. Como puede observarse, hay una tendencia a utilizar mayor número de detectores, y la emisión radial del tubo, lo que permite obtener la señal en varios detectores simultáneamente. La disposición de estos últimos en corona permite reducir (o incluso evitar por completo, como ocurre en E) su movimiento. El resultado es una reducción en los tiempos de irradiación del paciente, además de la posibilidad de visualizar estructuras en movimiento como el corazón.
La reconstrucción de la imagen a partir de las proyecciones se realiza mediante algoritmos, que pueden clasificarse en dos tipos: iterativos y analíticos. Los primeros realizan una predicción inicial de los valores de la matriz, que es posteriormente corregida en sucesivas iteraciones, basándose en el error entre los valores medidos y los predichos.
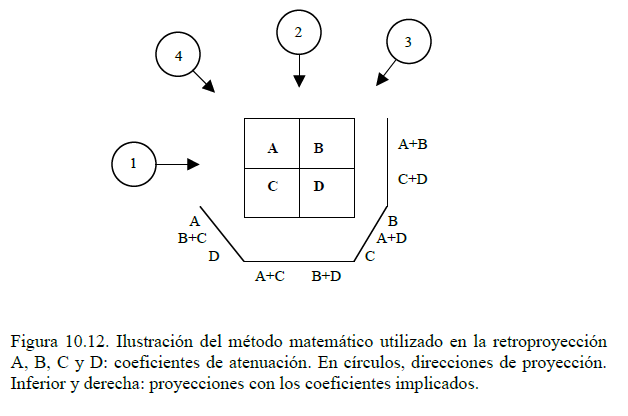
Los métodos analíticos se basan en el concepto de retroproyección. En este caso, partiendo de todas las proyecciones obtenidas que contengan información sobre el pixel ij, se realiza una proyección inversa y el área de intersección de todas ellas determina el valor correspondiente del pixel. Para esquematizarlo, supongamos una matriz de 2 x 2 =4 elementos. con coeficientes de atenuación A, B, C, D. Si el barrido se hace en posición horizontal (posición 1), se obtienen dos valores: A+B y C+D. Un segundo perfil se obtiene colocando el tubo de rayos X vertical (posición 2). Obtendríamos dos proyecciones más: A+C y B+D. En la posición de 45° con incidencia desde lado derecho (posición 3), se obtendría aproximadamente: A, C+ B, y D. Por último, para una incidencia de 45º hacia la izquierda (posición 4), también podríamos aproximar a: C, A + D, B. Si sumamos todos los valores en los que se ha visualizado A, tenemos 4A + B + C + D.
El proceso se repite para los demás elementos de volumen. Si de estas cuatro formaciones restamos un común denominador y lo dividimos por el número de obtenciones menos 1 (A+B+C+D)/3, obtendremos los coeficientes correspondientes a los cuatro elementos.
La imagen obtenida es una aproximación a la imagen real, que está afectada por efectos de bordes. Para minimizar esto, se realiza previamente una convolución entre cada perfil proyectado y una función filtro que modifica los valores de la proyección (retroproyección filtrada).
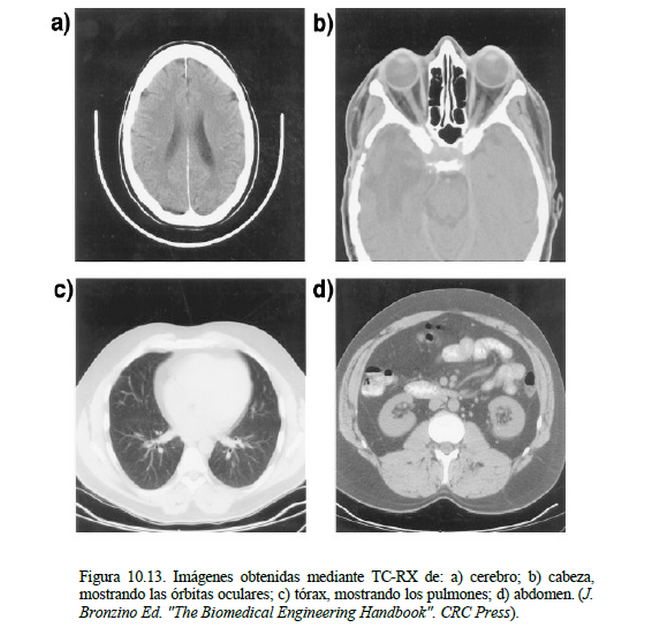
Los valores de los coeficientes de atenuación obtenidos son normalizados para hacerlos independientes de la energía del haz incidente y presentarlos como valores relativos al coeficiente de atenuación del agua. Esta escala se conoce como números CT, permitiendo expresar la atenuación de los tejidos entre –1000H (aire) y +1000H (hueso), en unidades H o Hounsfield, siendo 0H el valor correspondiente al agua. Posteriormente, se puede realizar una asignación de tonos de gris para la visualización de la imagen final, eligiendo una ventana de visualización adecuada para lograr un máximo contraste sobre las estructuras de interés. La siguiente figura muestra un ejemplo de diversas imágenes obtenidas mediante TC-RX.
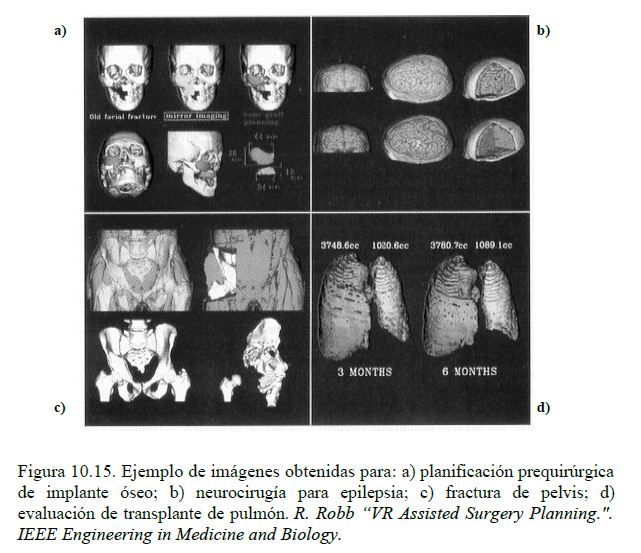
Aplicaciones médicas de la realidad virtual
La realidad virtual (RV) implica generación por computador de entornos táctiles, auditivos y visuales en 3D, y un conjunto de herramientas que permiten al usuario navegar e interactuar con objetos en el entorno generado por el computador. Estos dispositivos deben ser capaces de producir una inmersión del usuario en el mundo virtual, para lo cual se han desarrollado cascos con pantallas 3D, guantes y trajes, sistemas para producir efectos de movimiento o generadores de sonido espacial. En el campo de la IB, la realidad virtual se ha comenzado a aplicar en diversas áreas. A continuación se comentan las más importantes.
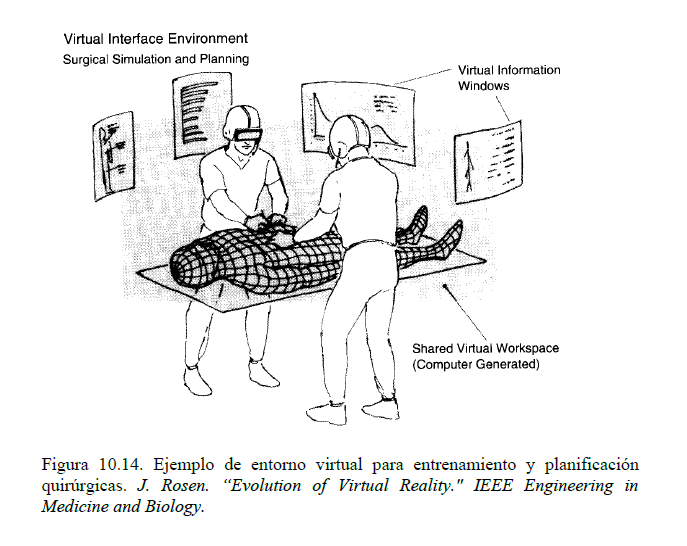
En entrenamiento quirúrgico, la RV permite incrementar la experiencia del nuevo cirujano mediante un sistema de simulación que permite una representación en tiempo real tanto de la instrumentación quirúrgica como de las estructuras anatómicas en 3D.
Utilizando este diseño, los cirujanos pueden practicar procedimientos y experimentar las posibles complicaciones y variaciones anatómicas encontradas durante una operación. En el caso de la planificación quirúrgica, relacionado con el anterior, el sistema proporciona la posibilidad al cirujano de planificar y simular una determinada intervención quirúrgica con anterioridad.
Las imágenes se obtienen a partir de las previamente obtenidas del paciente. Este método es útil en intervenciones de alto riesgo.
Otro campo de aplicación es el de la educación médica. En este caso, el sistema soporta simulación quirúrgica y exploración anatómica con fines educativos.
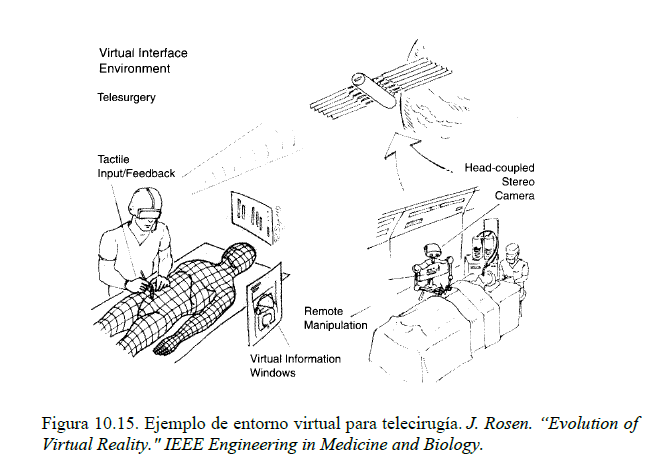
La RV permite la telepresencia tanto de expertos médicos (telemedicina) como de cirujanos (telecirugía). La telecirugía puede ser necesaria en algunos supuestos, como en caso de un paciente demasiado enfermo para poder ser trasladado, o que el cirujano especialista no esté presente en el lugar de la operación. En la figura 10.16 se muestra un ejemplo de entorno de telecirugía. El cirujano utiliza un entorno virtual similar al de la figura 10.14, en el que se sustituyen las imágenes que ve por las transmitidas desde las cámaras que incorpora el robot situado en el lugar donde se encuentra el paciente. Por consiguiente, tanto las imágenes como la realimentación de la posición y resistencia de los tejidos al bisturí que está utilizando son las correspondientes al paciente real, transmitidas mediante un enlace de telecomunicaciones. Por otra parte, los movimientos del cirujano son a su vez utilizados para controlar los propios movimientos del robot.
La aplicación de la RV en el campo de intervención sobre el comportamiento tiene como objetivo mejorar la respuesta de pacientes con determinadas patologías. Por ejemplo, en el caso de enfermos de Parkinson, el sistema de RV proporciona al paciente una imagen de un entorno estabilizado respecto a su propio movimiento. También se ha aplicado en enfermos con determinadas fobias, simulando situaciones que las provocan de manera controlada.
El uso de la RV en rehabilitación y estudios ergonómicos permite la evaluación funcional de movimientos de distintos tipos. Por ejemplo, la utilización de un guante con realimentación de la fuerza aplicada se ha utilizado para rehabilitación de mano. Análogamente pueden utilizarse sistemas para evaluar características ergonómicas.
Por último, en el campo de la ayuda a discapacitados, se han desarrollado sistemas para permitir o mejorar la comunicación de personas con discapacidades físicas. Por ejemplo, pueden utilizarse guantes para realizar funciones complejas con simples movimientos de mano, o incluso para convertir estos gestos en voz.
Bibliografía:
• “Ingeniería Biomédica”. J. Guerrero. Ed. Moliner 40. (2004)
• "Medical Instrumentation. Application and Design.". J. Webster Ed. Wiley. (1997)
• "Biomedical Digital Signal Processing". W. J. Tompkins Ed. Prentice Hall. (1992).
• "Introducción a la Bioingeniería". Serie Mundo Electrónico. Marcombo. (1988).
• "The Biomedical Engineering Handbook", J. Bronzino. CRC Press (2000)
• "Tratamiento Digital de Señales: Principios, algoritmos y aplicaciones". J. Proakis, D.
Manolakis. Prentice Hall. (1998)
• "Ingeniería Biomédica", Juan F. Guerrero Martínez 13079 -, 2010/2011